診所細胞治療品質認證常見Q&A
配合衛生福利部政策,本會自110年開辦診所細胞治療品質認證,彙整機構諮詢之常見問題,提供有興趣參加之機構參考。
【提出申請相關資料及流程】
| 序號 | 內容 |
|---|---|
| 1 | Q:目前診所細胞治療品質認證僅開放申請皮膚相關適應症,請問其他項目及適應症何時開放申請? A: 1. 衛生福利部業於110年5月11日以衛部醫字第1101663019A號函公告,有關診所細胞治療品質認證項目,現階段暫緩開放癌症及骨科適應症,僅開放特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法(以下簡稱特管辦法)附表三第三項、第四項所列皮膚相關之4種適應症。
2. 其他適應症開放時程將待現行開放項目施行一段期間後,並評估其他適應症於醫院端執行狀況,再由衛生福利部邀集相關專家討論。
|
| 2 | Q:如變更負責醫師未達6個月,但為原址設立且團隊成員不變,且簽署概括承受同意書(醫療機構代碼不變),是否符合認證申請資格? A: 1. 不符合。
2. 依現行衛生局認定原則,變更負責醫師即視為新設立機構,故請此類情形機構於變更負責醫師6個月後再行提出申請;惟若有特殊情形,將依當地衛生局認定為主。
|
| 3 | Q:若診所於其他地區有分店,名稱皆相同,請問此種情形屬於一間機構申請還是多間機構申請?認證費用應繳交幾間? A:因機構代碼不同,於法規認定上為不同機構,故申請資料及認證費皆須依照申請機構數個別提供。 |
| 4 | Q:請問診所的申請資格為何? A:依據診所細胞治療品質認證作業指引,欲提供細胞治療技術服務項目之診所,且符合下列情形: 1. 於所在地衛生局合法登記達6個月(含)以上,並符合醫療機構設置標準。
2. 過去二年內,未有因違反醫療相關法規遭衛生主管機關處停業以上處分。
3. 具欲施行細胞治療技術項目GTP認可之細胞製備場所合約。
4. 施行細胞治療技術醫師符合本認證查核項目及查證重點附表一之規範。
|
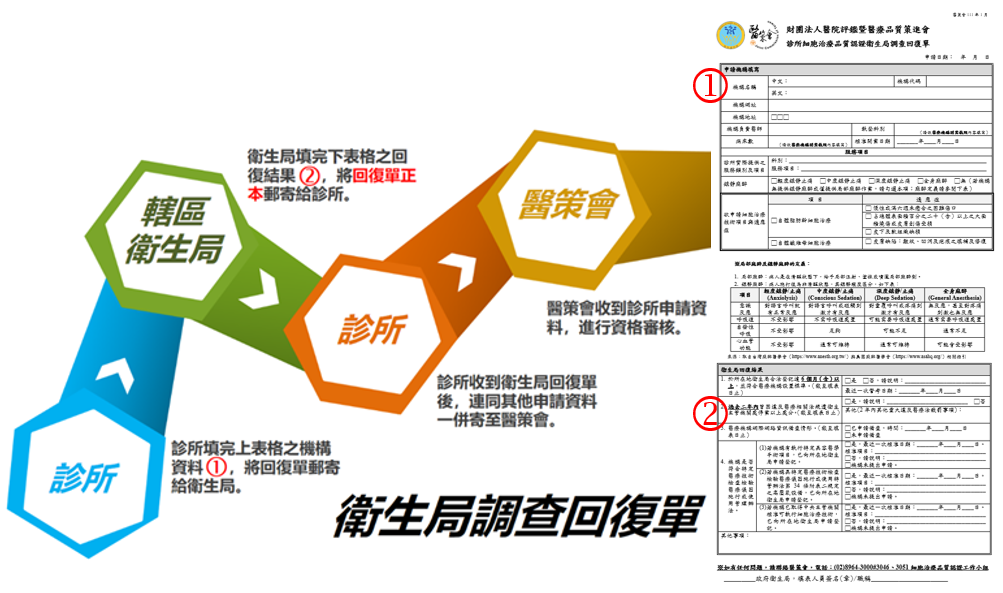
| 5 |
Q:請問衛生局調查回復單應如何提供?
|
| 6 | Q:如欲申請診所細胞治療品質認證,請問是否需提出細胞治療技術申請計畫書? A:診所通過診所細胞治療品質認證後,才可向衛生福利部提出細胞治療技術審查,屆時再行提出計畫書。 |
| 7 | Q:如欲申請診所細胞治療品質認證,請問施行醫師資格為何? A:依據診所細胞治療品質認證之查核項目及查證重點1.2第3點規範: 1. 須符合特管辦法第12及13條規定。
2. 須為專任醫師及符合診所細胞治療品質認證查核項目及查證重點附表一之資格。
|
| 8 | Q:請問非皮膚科、整形外科專科醫師,如何達到細胞治療技術項目施行10例(含)以上之經驗?如果在國外有發表過論文,回台灣開立診所,是否符合資格? A:診所細胞治療品質認證查核項目及查證重點附表一施行細胞治療技術醫師之資格所提「具本項細胞治療技術項目施行10例(含)以上之經驗」,此施行經驗應為國內已有的人體試驗或中央主管機關核准之細胞治療技術施行計畫等經歷,且施行醫師於施行時亦須經中央主管機關核准;前述施行經驗請檢附相關資料佐證,包含衛生福利部核准施行之證明、手術項目與內容、施行地點、指導者(含簽名)、病歷號等內容。 |
| 9 | Q:請問申請後如欲退費,認證費可以全退嗎? A:退費情形分為以下情況: 1. 機構若未通過申請之資格審查則將退回認證費。
2. 機構通過申請之資格審查後:
1. 實地訪視
(1) 約定實地訪視日期前:機構提出認證申請後,尚未約定實地訪視日期者,本會收取行政處理費用(20%認證費)。
(2) 約定實地訪視日期後:機構提出認證申請後,已約定實地訪視日期,除機構發生重大事件或不可歸責之原因外,不得調整日期,申請時繳交之認證費亦將不予退還。
2. 書面審查:通知書面資料繳交期限後,未於期限內繳交相關佐證資料者,本會收取行政處理費用(20%認證費)。
3. 機構變更負責醫師或遷址:一律取消認證申請並辦理退費,本會須收取20%認證費作為行政處理費用。
註1:前開「約定實地訪視日期」、「通知書面資料繳交期限」係指本會以電子郵件或函文方式正式通知機構之日期。
註2:前開「變更負責醫師」包含機構因故歇業由另位負責醫師於原址重新開業者。
|
| 10 | Q:請問如何尋找欲合作之細胞製備場所? A:請至衛生福利部官網-細胞治療技術資訊專區-細胞治療哪裡找-衛福部核准細胞治療技術-皮膚-篩選器點選「診所」,即可查看通過之機構合作的細胞製備場所;若想取得更多相關資訊可詢問食藥署。 |
【填寫申報資料相關問題】
-
機構自評資料表
| 序號 | 內容 |
|---|---|
| 1 | Q:有關自評資料表上的查核項目2.4「採集檢體及注射細胞製品之紀錄及病歷記載完整,並落實病歷管理」,如果我們是用電子病歷要怎麼準備審查? A:機構在準備各查核項目所列之準備文件時,若機構已將資訊電子化,請於實地訪視當日提供電腦供委員查詢。 |
| 2 | Q:有關自評資料表上的查核項目2.6「訂有藥品管理機制,且正確執行給藥」,我們是釋出處方箋給藥局的話,這項要如何填寫? A:如機構將處方箋釋出,讓民眾自行至藥局領藥,請於說明欄簡述執行情況,並於實地訪視當日檢附開立之處方箋,若有合作藥局亦可請藥局提供藥袋予機構作為本項佐證資料。 |
-
六個月內治療相關疾病病人名冊
| 序號 | 內容 |
|---|---|
| 1 | Q:有關六個月內治療相關疾病病人名冊有格式範本嗎?何時提供? A:「六個月內治療相關疾病病人名冊」之清單格式放置於本會官網申請資料附件下載區,請機構於實地訪查當日提供給委員勾選。 |
-
團隊成員一覽表
| 序號 | 內容 |
|---|---|
| 1 | Q:BLS證照是所有人員都要具備嗎?包含行政人員都須要具備? A:醫療照護成員皆要有BLS證照,但行政人員並未要求必須具備。 |
【實地訪視】
-
實地訪視程序相關事項
| 序號 | 內容 |
|---|---|
| 1 | Q:認證委員會安排幾位? A:原則上安排2位委員至機構進行實地訪視。 |
| 2 | Q:實地訪視時間多久? A:約120~150分鐘(不含會前會時段)。 |
| 3 | Q:請問實地訪視時間可以換嗎? A:若確認實地訪視日期後,除機構發生重大事件或不可歸責之原因外,不得調整日期,實地訪視期間遇天然災害(如:風災、水災、震災、土石流災害及其他天然災害),經機構所在地之縣市政府發布停班,則中止實地訪視作業,另擇期接續實地訪視認證作業。 註:前開「約定實地訪視日期」係指本會以電子郵件或函文方式正式通知機構之日期。 |
| 4 | Q:實地訪視當日診所需要哪些人員陪評? A:實地訪視當日請安排以下人員陪評: 1. 機構負責人。
2. 欲申請細胞治療技術項目之施行醫師或熟悉作業之人員(須為診所內部人員)。
註:醫師陪評請就實際執行處置作業情形向委員說明。 |
| 5 | Q:請問有關24項查核項目都要符合才能通過嗎? A:每項查核項目(不含不適用、免評)皆評為符合,則為通過;如有任一項查核項目評為不符合,則為不通過。 |
| 6 | Q:診所已於實地訪視前一個月繳交自評表,實地訪視當日還需要準備什麼資料嗎? A:請於實地訪視當日準備: 1. 衛生主管機關最近一次督導考核紀錄。
2. 六個月內治療相關疾病病人名冊。
3. 機構簡報(紙本或電子檔)。
4. 陪評人員名單。
5. 「診所細胞治療品質認證查核項目及查證重點」各查核項目所列之準備文件(紙本或電子檔)。
|
| 7 | Q:若申請認證之診所尚未施行細胞治療技術,請問實地訪視如何查證病歷? A:針對首次參與認證或尚未施行細胞治療技術之診所,故本認證實地訪視主要查核機構過去六個月內治療相關疾病病人之病歷是否符合法規及相關規範,並審視細胞治療相關作業程序,以評估機構是否達到施行細胞治療技術之標準。 |
-
查核項目及查證重點相關事項
| 序號 | 內容 |
|---|---|
| 1 | Q:器械委由外包廠商進行消毒,須備有什麼佐證資料? A:若診所器械委由外包廠商進行消毒,於實地訪視時須備有合約內容及消毒紀錄。 |
| 2 | Q:診所設有高壓鍋或執行EO消毒,於放置相關設備上有哪些注意事項? A:設有高壓鍋、EO消毒者,須有獨立消毒空間,不應放置於手術室及診間。 |
| 3 | Q:若有提供中度鎮靜止痛(含)以上之手術/處置,須備有什麼設備? A:執行中度鎮靜止痛(含)以上,至少須備有三合一生命監視器(包含血壓、血氧、心電圖)。 |
| 4 | Q:診所有哪些必備的急救設備與急救藥物? A:有關診所須備有之急救設備與急救藥物,請參考診所細胞治療品質認證查核項目及查證重點內之附表二。 |
| 5 | Q:請問診所欲設有細胞製品保存容器,請問相關的規範為何?如:溫度、流程等,是否有相關的規定、作業流程要求? A:請機構依據細胞製品特性訂定合理之標準作業流程及規範。 |
| 6 | Q:診所是否可配置細胞操作室,以進行細胞解凍、無菌操作及最終細胞製品調製作業嗎?還是僅能單純操作細胞製品解凍回輸? A:診所若涉及細胞治療技術之細胞製程(含處理、培養或儲存),除須依據細胞製品特性訂定相關作業程序及流程外,應於未來之細胞治療技術計畫書中載明實際操作程序,並依特管辦法第16條規定申請符合GTP規範之認可,始得執行。 |
| 7 | Q:請問診所存放藥品或細胞製品是否有特別規範? A: 1. 藥品:宜依藥品說明書內容執行,常規規範建議如下:
(1) 應有獨立之藥品儲存空間,及適當的空調及安全設施。
(2) 藥品冷藏用之冰箱,應備有不斷電裝置或接緊急電源,且有溫度紀錄。
(3) 藥品儲存空間/盒/箱之標示,應與所存放之藥品一致。
2. 細胞製品:依據細胞製品特性訂定合理之標準作業流程及規範。
|
| 8 | Q:請問每次回診治療都需要簽署同意書,是指一個完整的療程?還是一個療程中的多次回診治療皆需要簽署同意書? A: 1. 目前尚無診所施行細胞治療技術,故本認證實地訪視主要查核機構過去六個月內治療相關疾病病人,其治療流程是否簽署同意書(特別是侵入性處置)。
2. 按衛生福利部公告之「細胞治療技術同意書」及「細胞治療技術說明書」範本,醫療機構已載明細胞治療技術療程次數,爰未要求每次回診皆要簽署同意書。惟下列情況應重新簽具同意書:
(1) 醫療機構應於病人簽具細胞治療技術同意書後三個月內,施行技術,逾期應重新簽具同意書。
(2) 簽具同意書後病情發生變化者。
(3) 醫療機構為病人施行細胞治療技術後,如有再度為病人施行該技術之必要者,應重新簽具同意書。
|
【認證後相關事宜】
| 序號 | 內容 |
|---|---|
| 1 | Q:若認證結果為不通過,可以申復嗎?申復的條件及流程為何? A: 1. 依認證作業指引「八、認證程序(五)結果確認第3點」:機構對於認證結果有疑義者,得於接獲評定結果通知後一週內,檢附相關資料向辦理單位提出書面申復。
2. 本認證之結果及評量意見,皆以訪視委員當日所查證內容為評量依據,爰此,機構提出之申復佐證文件應為可舉證當日所查證有誤之內容,如佐證之申復資料是實地訪視後,機構後續進行改善之作為,將不符合受理申復之條件。
3. 若機構欲提出申復,請以公文方式寄送至本會,以利本會正式受理作業。
|
| 2 | Q:認證效期為幾年呢?到期的話,需要重新準備申請資料跟申請費用嗎? A:本認證通過效期為3年;再次認證之機構須於效期到期日前之開放申請期間,提出延續認證效期之申請,亦須重新繳交相關資料及認證費。 請參考認證作業指引「九、其他應配合事項」:通過認證之機構得於效期到期日前之開放申請期間,提出延續認證效期之申請;認證通過後之效期起始日,以前次效期終止日次日開始計算。惟逾期提出申請或訪視日於認證到期日後,則視為首次申請認證,本會將針對通過機構核予新的效期。 |
| 3 | Q:若診所於認證後,變更負責醫師、機構位置搬遷,認證通過的效期會失效嗎?需要重新準備認證嗎? A:通過認證之機構辦理歇業(含變更負責醫師)或遷址時,其認證效期即終止。 |
| 4 | Q:若診所通過認證後的施行醫師或服務項目有異動要如何處理? A:請參考認證作業指引「九、其他應配合事項」:通過機構於效期內,如施行醫師、服務項目、合作之細胞製備場所或樓地板面積等異動,應於事實發生30日內以函文通知辦理單位,並檢附變更之內容及相關資料。 |
| 5 | Q:診所想施行細胞治療技術,通過這個認證就可以施行嗎? A:否,通過醫策會「診所細胞治療品質認證」後,在認證的三年效期內,可向衛生福利部提出「細胞治療技術審查作業」,經衛生福利部核准才可以施行細胞治療技術。 |
| 6 | Q:若通過「診所細胞治療品質認證」後,欲新增其他細胞治療技術項目或適應症,需要重新接受實地訪視審查嗎? A:否,請參考認證作業指引「八、認證程序(二)查證方式」:認證效期內新增細胞治療技術項目或適應症:書面審查為主,視需要安排實地訪視;以及參考認證作業指引「九、其他應配合事項」:通過機構於效期內,針對目前開放診所施行之皮膚相關細胞治療項目及適應症,如欲新增項目或適應症,依前開認證作業指引第四點、第七點及第八點規定申請新增細胞治療技術項目或適應症認證。 |
| 7 | Q:若通過「診所細胞治療品質認證」後,欲更換合作之細胞製備場所,應如何處理? A:請參考認證作業指引「九、其他應配合事項」:通過機構於效期內,如施行醫師、服務項目、合作之細胞製備場所或樓地板面積等異動,應於事實發生30日內以函文通知辦理單位,並檢附變更之內容及相關資料。本會將視需求以書面審查或實地訪視方式進行確認。 |
【其他】
| 序號 | 內容 |
|---|---|
| 1 | Q:醫策會針對診所細胞治療品質認證,請問是否有事先諮詢輔導機制? A:本會辦理說明會針對申請作業及查核內容詳細介紹,並於本會官網放置相關訊息,另亦提供專人電話及電子郵件諮詢服務。 |
| 2 | Q:請問診所細胞治療品質認證、細胞治療技術審查、細胞製備場所GTP查核作業費用? A: 1. 財團法人醫院評鑑暨醫療品質策進會診所細胞治療品質認證:
(1) 首次申請或延續認證效期者,新臺幣16萬元。
(2) 於認證效期內申請新增細胞治療技術項目或適應症者,新臺幣10萬元。
2. 衛生福利部細胞治療技術審查:新臺幣8萬元。
3. 衛生褔利部食品藥物管理署細胞製備場所GTP認可申請:新臺幣12萬元。
|
| 3 | Q:請問細胞製備場所(CPU)的增殖細胞的設備,是否需要醫療器材許可證? A:細胞製備場所內的設備並非診所細胞治療品質認證範圍。建議參考衛生福利部食品藥物管理署(TFDA)與財團法人醫藥品查驗中心(CDE)規範。 |
| 4 | Q:如診所可執行細胞治療技術,針對細胞治療病人的退費機制有無規範? A:細胞治療技術的退費機制並非診所細胞治療品質認證範圍。建議向衛生福利部細胞治療技術收費方式審查小組諮詢意見。 |
對於本認證如有問題,歡迎聯絡本會診所細胞治療品質認證工作小組
電 話:(02)8964-3000 分機3023劉小姐、3022艾先生
服務信箱:ctqc@jct.org.tw