新醫療技術人體試驗案審查作業
依據人體試驗管理辦法第2、3條所提,醫療機構將新醫療技術列入常規醫療處置項目前,應施行人體試驗研究,向中央主管機關申請核准。遂衛生福利部依據醫療法第78條及79條規定受理新醫療技術人體試驗案審查作業,惟為加速新醫療技術案審查作業,衛生福利部自110年6月起委託醫策會協助研擬「新醫療技術人體試驗案-審查標準作業程序」,以利申請者及人體研究倫理審查委員會依循,及執行新醫療技術人體試驗案審查作業,並持續檢討改善相關作業流程,以保障受試者及研究對象權益與安全。
為提高國內醫療技術水準及預防疾病上之需要,衛生福利部公告「新醫療技術人體試驗案-審查標準作業程序」,並委託財團法人醫院評鑑暨醫療品質策進會辦理案件審查相關行政事務。
一、 受理範圍:
(一) 新醫療技術人體試驗案之案件屬性判定。
(二) 新醫療技術人體試驗案之審查作業。
二、 流程圖:
(一) 新醫療技術人體試驗案之屬性判定作業流程圖
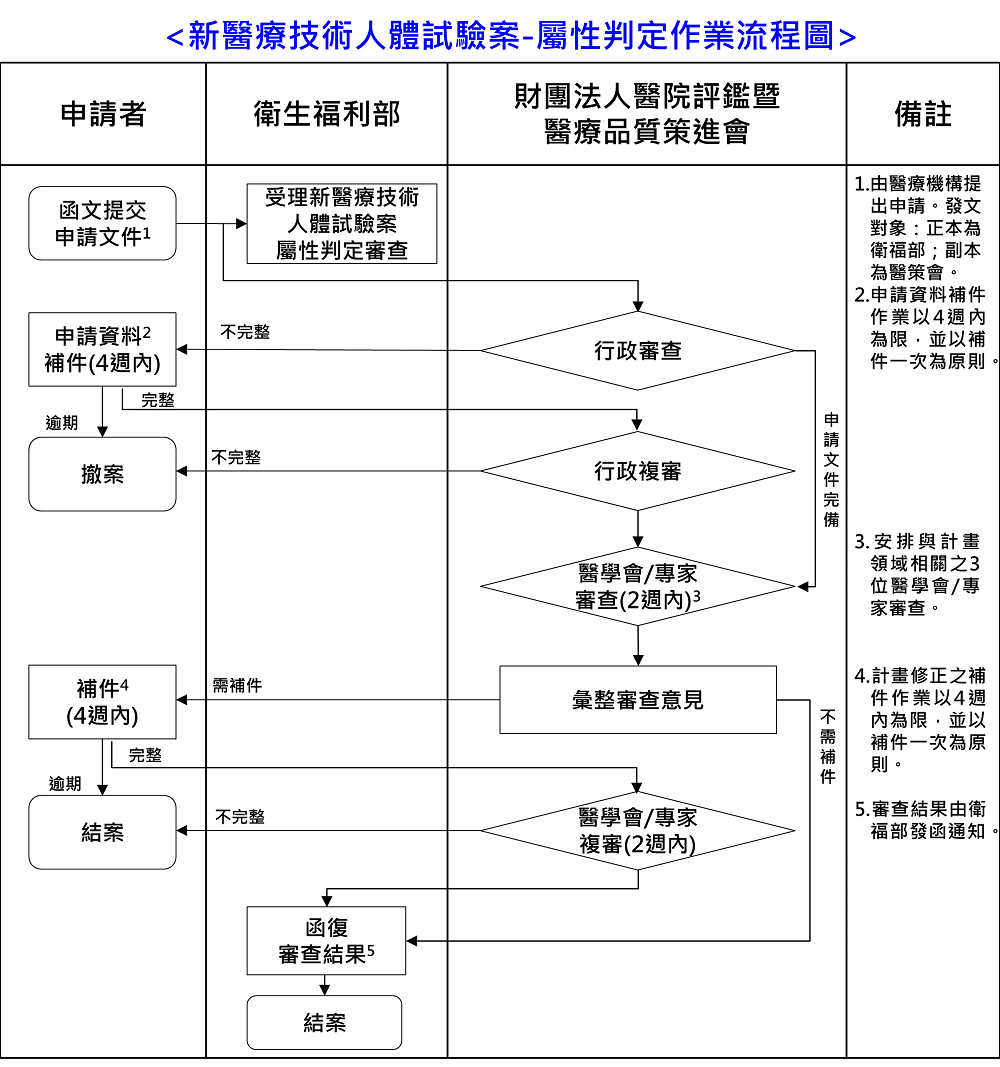
(二) 新醫療技術人體試驗案之新案審查作業
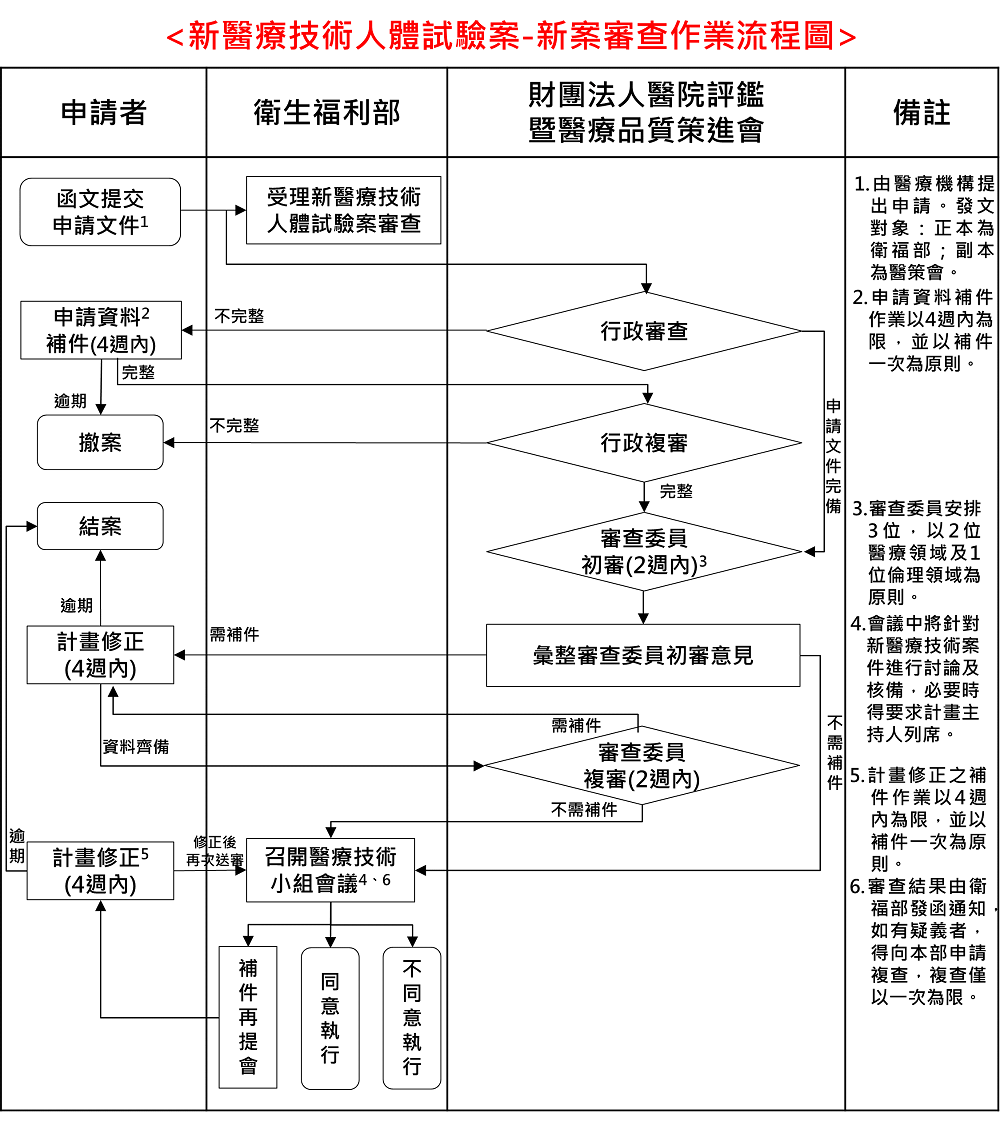
(三) 新醫療技術人體試驗案之新案審查作業變更案/期中/結案審查作業流程圖
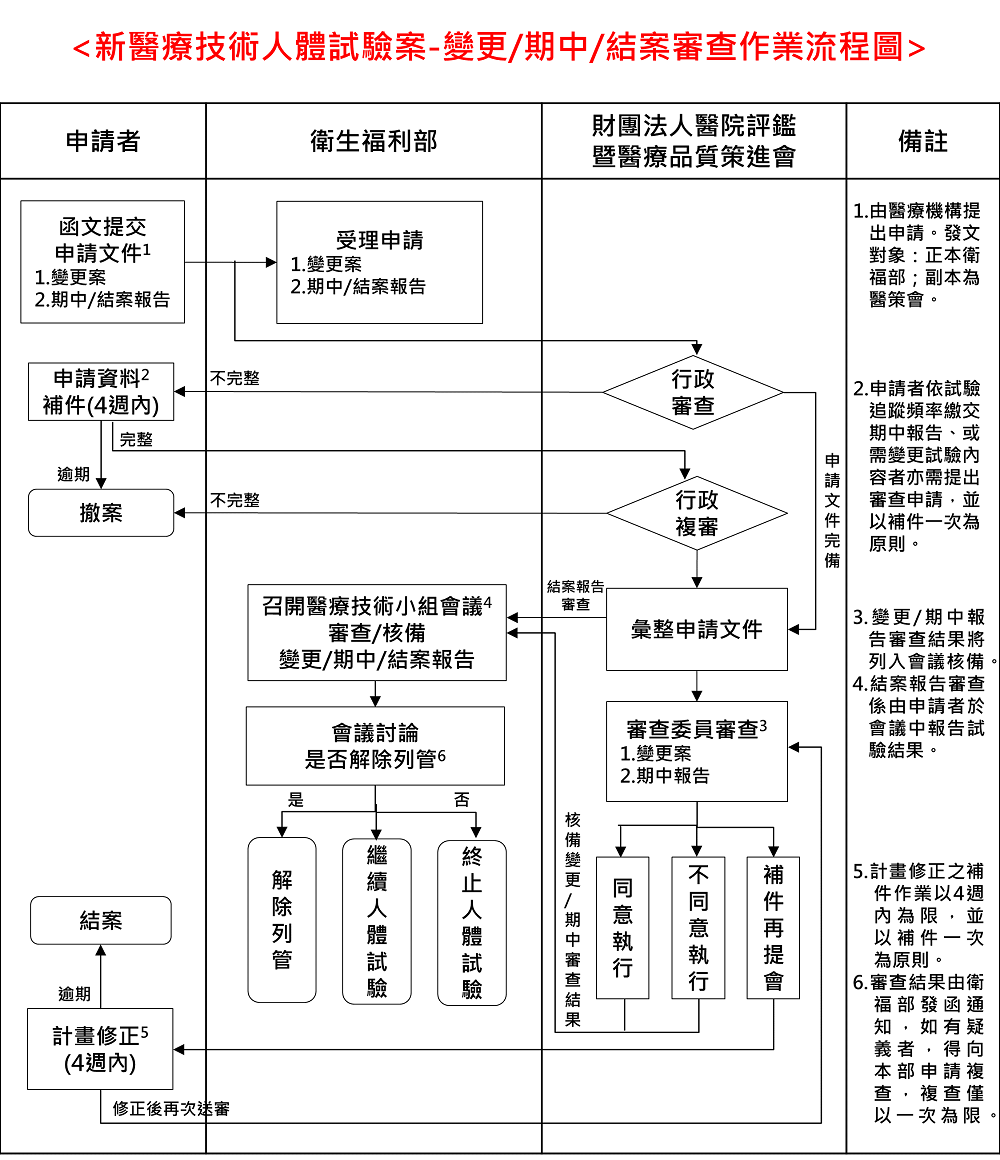
三、 有關審查須檢附之文件及審查流程,請參考下方連結自行下載參閱。
四、 本會於111年4月11日辦理111年度人體研究倫理審查委員會教育訓練課程,並提供【新醫療技術人體試驗案送審申請須知】課程講義供申請者下載參考。
如有疑問,歡迎聯繫本會IRB/EC工作小組,或至服務信箱詢問,謝謝您!
電話:(02)-8964-3000 分機3057黃小姐、分機3053洪小姐
服務信箱:irb-ec@jct.org.tw
附件下載
111年度人體研究倫理審查委員會教育訓練課程講義【新醫療技術人體試驗案送審申請須知】



















